Blog
•
31 out. 2025
Artigo escrito por: Daniela Costa / Revisado por: Paola Cappelletti
Cenário atual da autorização de produtos foodtech com base em cultura de células.
O mundo assiste a uma transformação silenciosa, mas profunda, na forma de produzir proteínas.
O que antes era uma ideia futurista, “carne feita em laboratório”, agora é realidade biotecnológica, com impactos diretos sobre sustentabilidade, segurança alimentar e inovação tecnológica.
A cultura de células, tecnologia amplamente consolidada em pesquisa biomédica, é utilizada há décadas para modelar doenças humanas, testar medicamentos, avaliar a segurança de cosméticos e substâncias químicas, produzir vacinas, e compreender mecanismos moleculares de processos como inflamação, câncer e regeneração tecidual.
Essa mesma base científica, agora expande fronteiras e ingressa no setor alimentício, aplicando-se à produção de proteínas e tecidos comestíveis obtidos por cultura celular. A transformação da carne cultivada em uma realidade comercial é resultado de um movimento coordenado entre pesquisa científica, inovação biotecnológica e avanço regulatório em diferentes partes do mundo.
Em Singapura, pioneira mundial na regulamentação, a Singapore Food Agency (SFA) autorizou em 2020 a venda de carne de frango cultivada da empresa Eat Just, tornando o primeiro país a permitir o consumo de um alimento derivado de cultura celular. Desde então, eles revisam continuamente suas diretrizes para acelerar a entrada de novos produtos no mercado e garantir rotulagem transparente e avaliação de segurança rigorosa.
Nos Estados Unidos, a Food and Drug Administration (FDA) deu início a essa revolução em 2022, ao aprovar o frango cultivado da Upside Foods, tornando-o o primeiro alimento à base de cultura celular liberado para consumo humano no país.
Mais recentemente, em 2025, a Wildtype Foods obteve aprovação para comercializar o primeiro salmão cultivado, totalmente produzido por cultura de células, um marco histórico que consolida a biotecnologia alimentar como campo estratégico da ciência e da economia verde.
Em Israel, o Ministério da Saúde aprovou, em 2024, a comercialização da carne bovina cultivada da Aleph Farms, após anos de pesquisa e testes de segurança, tornando-se o primeiro país a liberar carne cultivada bovina.
Na União Europeia, a Autoridade Europeia para a Segurança dos Alimentos (EFSA) conduz a avaliação científica de “novos alimentos”, conforme o regulamento aprovado em 2018.
Embora o bloco ainda não tenha aprovado a venda de carne cultivada, alguns países já investem em centros de pesquisa para o desenvolvimento de carne cultivada.
Esses avanços mostram que a carne cultivada deixou o laboratório e alcançou o cenário regulatório internacional, sendo discutida não apenas sob o ponto de vista científico, mas também ético, político e econômico, um indicativo de que a biotecnologia alimentar se tornará um novo pilar da segurança alimentar global.
Mas o que é carne cultivada e como é produzida?
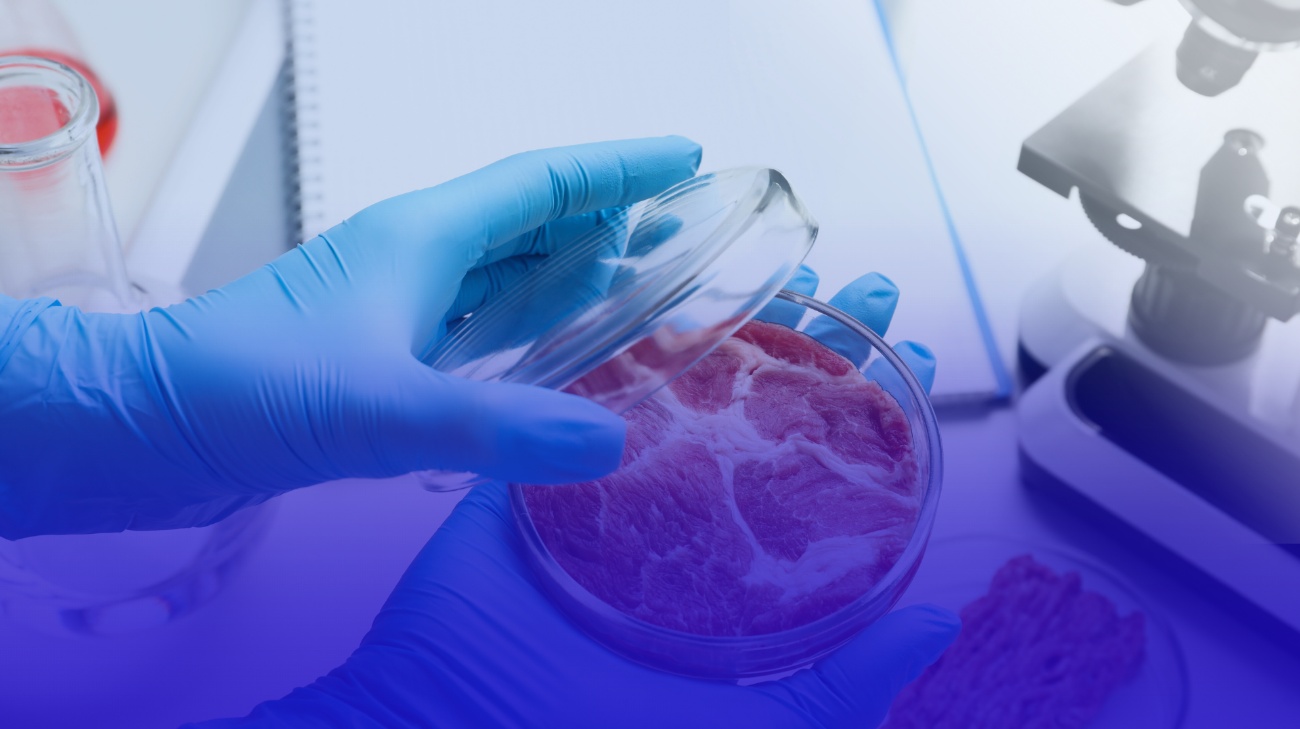
A carne cultivada, também chamada de cell-cultivated meat, é obtida a partir de células animais isoladas que se multiplicam fora do organismo, em ambiente controlado, sem necessidade de abate.
Esse campo emergente, conhecido como agricultura celular, aplica princípios da biologia de células-tronco, engenharia de tecidos e ciências animais para criar produtos agrícolas diretamente a partir de células cultivadas in vitro.
Essas células podem ser musculares, satélites (células tronco musculares), mesenquimais ou pluripotentes induzidas, dependendo do tecido desejado, músculo, gordura ou tecido conectivo.
Para se tornarem matéria-prima de carne cultivada, elas precisam apresentar alta capacidade proliferativa e potencial de diferenciação, garantindo viabilidade e estabilidade durante o processo produtivo.
A escolha da linhagem celular e o desenvolvimento de meios de cultura são etapas críticas que determinam o custo, a qualidade e a reprodutibilidade do produto final.
Como começa a cultura de células para a carne cultivada?
O processo de produção segue etapas bem definidas:
Coleta de células – realizada por biópsias ou uso de tecidos post-mortem do animal de interesse.
Proliferação celular – expansão em biorreatores, sob controle rigoroso de oxigênio, nutrientes e estímulos mecânicos e condições estéreis que maximizam o crescimento e a viabilidade celular.
Diferenciação – indução das células a formar fibras musculares e adiposas maduras.
Estruturação – uso de arcabouços (scaffolds) que organizam o tecido tridimensionalmente. O tipo de arcabouço, e sua composição bioquímica, influencia diretamente a textura, consistência e sabor do produto final, tornando-se um componente essencial da engenharia do alimento.
Cada uma dessas etapas reflete princípios já consolidados em laboratórios de cultura de células, aplicados agora para criar tecidos alimentares comestíveis sob condições estéreis e controladas.
O mesmo rigor técnico que assegura reprodutibilidade e biossegurança na pesquisa biomédica começa a moldar o futuro da alimentação.
Sustentabilidade e impacto ético
A carne cultivada não representa apenas uma inovação tecnológica, ela também oferece uma resposta concreta aos desafios ambientais e éticos da produção de proteína animal.
Os impactos ambientais da carne cultivada continuam sendo amplamente estudados, e os resultados mais recentes indicam um cenário promissor, ainda que dependente da maturidade tecnológica do setor.
De acordo com Smetana et al. (2023) e Ong et al. (2023), estudos de análise de ciclo de vida (LCA) indicam que, em escala comercial, a produção de carne cultivada pode reduzir significativamente o uso de água e terra, além de diminuir as emissões de gases de efeito estufa, especialmente quando apoiada por fontes de energia renovável e meios de cultura otimizados.
Contudo, os autores ressaltam que a eficiência energética e a composição do meio de cultura são fatores determinantes para que essas reduções se concretizem.
Outros trabalhos, como o de Alexander et al. (2024), destacam que, se o processo depender de energia fóssil ou meios ricos em componentes de origem animal, o benefício ambiental tende a ser reduzido — reforçando a importância do avanço em meios livres de soro e na transição para energia limpa.
De forma geral, a literatura recente converge ao reconhecer que a carne cultivada tem potencial para reduzir o impacto ambiental da pecuária convencional, desde que evolua para sistemas produtivos eficientes e sustentáveis.
Além do aspecto ecológico, a carne cultivada elimina a necessidade de abate animal, reduz o risco de zoonoses e dispensa o uso profilático de antibióticos, práticas associadas à criação intensiva (Ong et al., 2023). Esses benefícios combinados explicam o crescimento do investimento público e privado no setor, impulsionando pesquisas em biotecnologia alimentar e agricultura celular.
E há outro ponto interessante: a carne cultivada também permite a personalização nutricional.
De acordo com Stephens et al. (2021), é possível ajustar o perfil nutricional do produto combinando células musculares, adiposas e diferentes tipos de scaffolds.
Essa abordagem possibilita criar alimentos com menos gordura, mais proteína ou até enriquecidos com ácidos graxos ômega-3, algo impossível de controlar com precisão na pecuária tradicional.
O cenário brasileiro: inovação e regulação
O Brasil, tradicional gigante do agronegócio, começa a se destacar também na fronteira das proteínas alternativas e da agricultura celular, unindo biotecnologia e sustentabilidade.
Nos últimos anos, startups e instituições de pesquisa vêm adaptando tecnologias de cultura de células, fermentação de precisão e bioengenharia de tecidos ao contexto nacional, impulsionadas por parcerias público-privadas e editais de inovação. Entre os principais nomes estão a Ambi Realfood, Sustineri Piscis e Cellva Ingredients. Instituições como a Embrapa, UFPR, UFMG, UNICAMP e UFRJ têm ampliado suas pesquisas em engenharia de tecidos alimentares e meios de cultura nacionais, consolidando o Brasil como polo emergente em foodtech e biotecnologia sustentável.
Esses movimentos demonstram como a cultura de células, base técnica já dominada em laboratórios biomédicos, se transforma agora em vetor de inovação alimentar.
RDC nº 839/2023 – o marco regulatório no Brasil
Em dezembro de 2023, a Agência Nacional de Vigilância Sanitária (ANVISA) publicou a Resolução RDC nº 839/2023, que atualiza as regras para avaliação e aprovação de novos alimentos e ingredientes.
“Consideram-se novos alimentos ou ingredientes aqueles obtidos por processos ou fontes inéditas, incluindo produtos de culturas de células ou de tecidos de origem animal, vegetal, fúngica ou algal.”
(Resolução RDC nº 839/2023 – Diário Oficial da União, 15/12/2023)
Com essa norma, o Brasil se junta a países como Singapura, Israel e Estados Unidos, que já possuem marcos regulatórios consolidados.
O próximo desafio está na fiscalização e auditoria, abrindo espaço para profissionais com formação em cultura celular, biossegurança e toxicologia in vitro contribuírem ativamente nesse novo mercado.
Impactos para a cultura de células e a toxicologia in vitro
A biotecnologia alimentar depende da mesma base técnica empregada em laboratórios de pesquisa: cultura celular, controle de qualidade e rastreabilidade.
Por isso, profissionais treinados em Boas Práticas em Cultura de Células tornam-se peças-chave na transição entre o campo biomédico e o setor foodtech.
Competências em alta:
- Manutenção e caracterização de linhagens celulares.
- Controle microbiológico e detecção de micoplasma.
- Desenvolvimento de meios sem soro e formulações definidas.
- Cultivo em biorreatores e diferenciação controlada.
- Gestão da rastreabilidade e validação da viabilidade celular.
- Essas práticas asseguram reprodutibilidade, segurança e conformidade, requisitos essenciais tanto para pesquisas quanto para produtos alimentares inovadores.
A cultura de células, que há décadas sustenta a pesquisa biomédica, agora avança para o setor de alimentos, unindo ciência, sustentabilidade e inovação.
Com a aprovação internacional de carnes cultivadas e a atualização regulatória da ANVISA, o Brasil se posiciona como um país capaz de liderar a próxima revolução alimentar baseada em biotecnologia.
Quer se preparar para essa nova fronteira?
O BCRJ oferece cursos especializados em Boas Práticas em Cultura de Células, Cultura de Células 3D e Toxicologia in vitro, com foco em estudos de segurança. Venha aprender os fundamentos que garantem qualidade, rastreabilidade e inovação em cultura celular, da bancada ao prato.
📩 Informações: [email protected]
Acompanhe nossas publicações para mais conteúdos sobre inovação científica.
Parceiros: Bio Nutrientes Brasil | Merck
BCRJ #CellCulture #CulturaCelular #BoasPráticas #Toxicologiainvitro #Toxicologia #Biotecnologia #CarneCultivada #ProteínasAlternativas #ANVISA #RDC839 #CiênciaSemCrueldade #BioNutrientes #Merck
Referências
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA (ANVISA). Resolução RDC nº 839, de 14 de dezembro de 2023. Diário Oficial da União, Brasília, DF, 15 dez. 2023. Disponível em: https://www.in.gov.br/en/web/dou/-/resolucao-rdc-n-839-de-14-de-dezembro-de-2023-531394967. Acesso em: 29 out. 2025.
ALEXANDER, P. et al. Life cycle assessment of culture media with alternative compositions for cultivated meat. The International Journal of Life Cycle Assessment, v. 29, n. 3, p. 540–552, 2024. DOI: 10.1007/s11367-024-02350-6
CONGRESSIONAL RESEARCH SERVICE (CRS). Cell-Cultured Meat: Policy and Regulatory Issues. Washington, D.C., 2024. Disponível em: https://www.congress.gov/crs-product/R47697. Acesso em: 29 out. 2025.
EMBRAPA. Brasil está na vanguarda no desenvolvimento de carne cultivada. 2024. Disponível em: https://www.embrapa.br/busca-de-noticias/-/noticia/77704192/brasil-esta-na-vanguarda-no-desenvolvimento-de-carne-cultivada. Acesso em: 28 out. 2025.
EUROPEAN FOOD SAFETY AUTHORITY (EFSA). Novel Foods Regulation (EU) 2015/2283 and scientific opinions on cultivated meat. Parma, 2023. Disponível em: https://www.efsa.europa.eu/en/topics/topic/novel-food. Acesso em: 29 out. 2025.
FOOD AND DRUG ADMINISTRATION (FDA). FDA completes first pre-market consultation for human food made using animal cell culture technology. Silver Spring, 2022. Disponível em: https://www.fda.gov/food/hfp-constituent-updates/fda-completes-first-pre-market-consultation-human-food-made-using-animal-cell-culture-technology. Acesso em: 29 out. 2025.
GOOD FOOD INSTITUTE BRASIL (GFI BRASIL). Panorama das proteínas alternativas no Brasil: desafios e oportunidades. Brasília, 2024. Disponível em: https://gfi.org.br/. Acesso em: 29 out. 2025.
GOOD FOOD INSTITUTE BRASIL (GFI BRASIL). Carne cultivada pode ser considerada halal? Brasília, 2024. Disponível em: https://gfi.org.br/en/carne-cultivada-pode-ser-considerada-halal/. Acesso em: 29 out. 2025.
ISRAEL MINISTRY OF HEALTH. Israel approves first cultivated beef steak by Aleph Farms. Jerusalém, 2024. Disponível em: https://www.health.gov.il/. Acesso em: 29 out. 2025.
ONG, K. L. et al. Environmental impacts of cultured meat: a cradle-to-gate life cycle assessment. Food Research International, v. 180, p. 112257, 2023. Disponível em: https://pubmed.ncbi.nlm.nih.gov/39840401/. Acesso em: 29 out. 2025.
SMETANA, S. et al. Ex-ante life cycle assessment of commercial-scale cultivated meat production in 2030. The International Journal of Life Cycle Assessment, v. 28, n. 7, p. 1324–1338, 2023. DOI: 10.1007/s11367-022-02128-8.
SINGAPORE FOOD AGENCY (SFA). Speech by Ms Grace Fu, Minister For Sustainability And The Environment, At The Launch Of The Future Ready Food Safety Hub On 27 April 2021 At Nanyang Technological University.
STEPHENS, N. et al. Cell sources for cultivated meat: applications and considerations. International Journal of Molecular Sciences, v. 22, n. 14, p. 7656, 2021. DOI: 10.3390/ijms22147656.